小鼠模式在神經退化疾病研究之應用
邱清旗 副研究員
林口長庚醫院神經科學研究中心
前言
隨著全球人口老化問題,老化相關疾病和神經退化疾病發生率亦逐年增加,探討老化與神經退化相關機制,有助於開發延緩老化與神經退化治療,不僅能提升老人與患者生活品質,對社會有莫大助益。實驗動物模式在神經科學與神經退化疾病研究上廣泛應用。在認知與行為神經科學方面,實驗動物也是幫助研究發展的模型。實驗動物不僅讓研究人員探究神經科學議題,了解神經退化疾病的致病機轉研究,也幫助開發治療藥物,對人類健康有研究有著莫大的助益。
實驗動物模式在神經退化疾病的應用
從線蟲、果蠅、斑馬魚、囓齒類動物到靈長類是廣泛研究神經退化疾病的動物模式,其中以囓齒類的大鼠與小鼠最常使用的實驗動物。
神經退化疾病以阿茲海默症與帕金森病最為常見,雖然真正的原因並不清楚,但目前發現許多基因突變會造成神經退化,造成神經細胞內過多異常蛋白質堆積,如 β -澱粉樣蛋白 (amyloid-β; Aβ)、濤蛋白 (tau)、突觸核蛋白(α-synuclein) 與 TDP-43 等蛋白質,也是重要的病理特徵,這也提供利用小鼠來探討神經退化疾病的契機[1]。以基因突變造成的神經退化疾病雖然無法全然解釋所有神經退化疾病的成因,但提供了探討神經退化的機制與方向,有助於開發神經退化疾病的檢測方法、藥物標的或治療方法。相較於細胞模式,實驗動物能模擬複雜的神經系統和神經迴路,此外也呈現神經元、神經膠細胞與其他細胞間的作用。
神經退化疾病之小鼠模式
神經退化疾病目前沒有完全治癒的治療方法,發展具有治療效果的藥物是目前當物之急,利用具有神經退化疾病病理特徵的小鼠模式或是基因編輯小鼠,使其能更精確神經退化疾病病程,探討疾病致病機轉,並能應用於藥物臨床前測試。
1.阿茲海默症小鼠模式
阿茲海默症患者大多為偶發型 (sporadic),其中具遺傳性所佔比率少於 5%。近年來研究發現β-澱粉樣前驅蛋白基因 (amyloid-β precursor protein; APP)、早老素- 1 (Presenilin-1; PSEN1)與 MAPT (microtubule-associated protein tau) 基因突變會造成遺傳性阿茲海默症。研究人員利用基因編輯建立阿茲海默症相關基因的基因轉殖鼠,提供研究阿茲海默症的契機。目前常用的基因轉殖小鼠有目前大約有 164 種阿茲海默症的基因轉殖小鼠,從表現單一基因突變 (APP) 到同時表現多個突變基因 (APP、PSEN1與MAPT) 的基因轉殖小鼠[2-4]:
(1) APP 基因轉殖小鼠 (Amyloid-β precursor protein precursor; APP ransgenic mice model)
大量表現突變β-澱粉樣前驅蛋白基因轉殖小鼠(mutant amyloid-β precursor protein precursor; APP transgenic mice) 是最常用來表現類似阿茲海默症病理特徵的基因轉殖小鼠,其中最常使用 APP659、APP751、APP770 等突變基因型,造成小鼠腦部出現 β-澱粉樣蛋白質囤積,造成小鼠在記憶和學習功能異常,應用於模擬阿茲海默症病程。PDAPP 基因轉殖小鼠便是利用 PDGF-β promoter 誘導大量表現突變APP (APPV717F) 基因,在大腦皮層和海馬迴區域出現澱粉樣斑塊,造成神經突觸和認知功能缺損。
(2) Presenilin 基因轉殖小鼠 (Presenilin; PSEN)
早老素 1 與 2 (PSEN1, PSEN2) 是 γ 分泌酶複合物 (γ-secretase complex) 中重要的組成,在阿茲海默症病人中也發現許多重要突變,影響 γ 分泌酶活性,產生過多 Aβ42,造成神經細胞死亡。但在小鼠模式中單獨表現突變 Presenilin 基因,只會觀察到 Aβ42 明顯增加,並無澱粉樣斑塊產生。因此後續發展出同時表現突變APP和突變 PSEN1 基因轉殖小鼠,加速病理產生的病程,且較早能觀察到澱粉樣斑塊沉積和認知能力缺損。5xFAD 小鼠模式便是同時表現突變 APP 和突變 PSEN1 的基因轉殖動物模式,小鼠在非常早期時就會有類似阿茲海默症的病理特徵,在六個星期大時便能發現神經細胞內出現 β-澱粉樣前驅蛋白堆積,在八個星期左右就會出現澱粉樣斑塊沉積。
(3) Tau 基因轉殖小鼠
MAPT 基因會因為不同的基因剪接 (splicing),產生六種亞型 (isoform) 濤蛋白質(Tau)。MAPT基因在人類腦部會產生 3R 和 4R 混合亞型的濤蛋白質,但在老鼠腦部只會有 4R亞型的濤蛋白。在臨床阿茲海默症患者發現突變濤蛋白 – P301L 和 P301S。因此,最常使用的Tau基因轉殖小鼠是同時表現 4R 濤蛋白和突變 (P301L 或 P301S) 濤蛋白,造成神經細胞中產生經纖維糾結 (neurofibrillary tangles),導致神經退化。
(4) ApoE 基因轉殖小鼠
ApoE 基因序列上的變異產生因 ApoE2、ApoE3 和 ApoE4 三種變異亞型,其中 ApoE4 會造成 β – 澱粉樣蛋白堆積,且會認知功能損傷情況。人類與老鼠 ApoE 除了在基本功能上有所不同對於 β – 澱粉樣蛋白親合力也有所不同。但 ApoE4 基因轉殖小鼠中,大量表現 ApoE4 確實會產生阿茲海默症的病理特徵與記憶能力缺損。
(5) 基因嵌入小鼠 (Knockin mouse models)
除了基因轉殖小鼠,近年來發展基因嵌入小鼠不僅能呈現阿茲海默症相關病理特徵,且是更能接近阿茲海默症生理狀態的小鼠模式。 APP 基因嵌入小鼠澱粉樣前驅蛋表現量與正常老鼠一樣,減少了大量表現突變β-澱粉樣前驅蛋白造成的干擾,與阿茲海默症的細胞生理狀態一樣表現在確切的腦區和神經細胞。其他突變 APP (KM670/671NL, V717F) 基因嵌入小鼠在六個月大時會有 β -澱粉樣蛋白堆積,18 個月大時出現記憶功能缺損。因此利用阿茲海默症相關基因建立的突變基因嵌入小鼠也提供研究阿茲海默症病理機轉的動物模式。
(6)化學物質或藥物誘導小鼠模式 (Chemically induced mouse models)
利用化學物質或是藥物使小鼠出現類似阿茲海默症的認知及記憶力缺損,例如鋁、銅、鋅、 D -半乳糖 (D-galactose)、Streptozotocin 毒素或是 Scopolamine 藥物都是常用來誘導小鼠產生認知與記憶力缺損的方法。
2.帕金森病小鼠模式
帕金森病是僅次於阿茲海默症的常見神經退化疾病,大多帕金森病患者為偶發性,僅有 5~10% 患者發現與基因有關。帕金森病的特徵是在中腦黑質區 (substantia nigra pars compacta) 內多巴胺神經細胞逐漸死亡所造成,在帕金森病患者的神經系統會發現錯誤摺疊突觸核蛋白 (misfolded α -synuclein) 堆積在路易氏體 (Lewy bodies) 與神經軸突 (neurites)。腦部的多巴胺神經死亡會造成臨床上的動作障礙。目前研究發現基因突變與環境因素會引起帕金森病,因此利用帕金森病相關基因的突變基因嵌入小鼠或是神經毒素誘導小鼠來探討病理機轉,也能用來作為藥物開發的臨床前測試動物模式。目前利用最常用來研究帕金森病的小鼠模式有:
(1)神經毒素誘導小鼠 (Neurotoxin-induced PD mouse models)
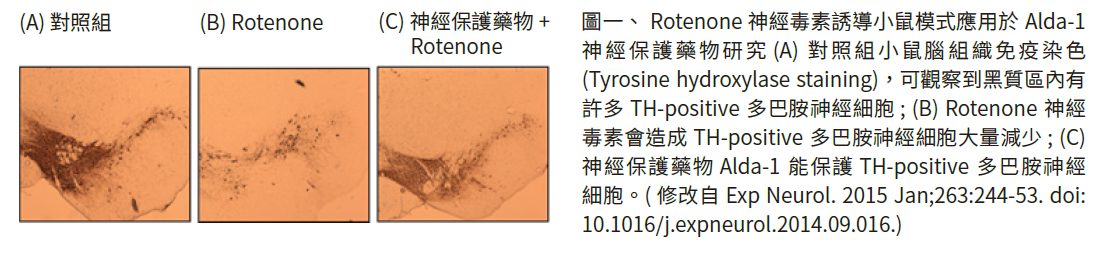
在神經毒素誘導小鼠目前最常應用 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)、6-hydroxydopamine (6-OHDA)與rotenone化學物質來造成多巴胺神經細胞的死亡 (圖一),並造成小鼠出現動作功能障礙。神經毒素誘導小鼠雖然具有明顯多巴胺神經細胞死亡 (圖一),雖然無法應用於神經退化的機轉研究,這類的小鼠模式缺少重要的帕金森病病理特徵-路易氏體。但神經毒素誘導小鼠能應用於神經保護藥物或是治療方法的開發[5]。
(2) 突變帕金森相關基因嵌入小鼠
目前發現有約有 21 個基因與帕金森病有關[6]。例如突觸核蛋白基因與 LRRK2 基因的突變會造成顯性遺傳帕金森病 (autosomal dominant PD); 在 PINK1 基因、DJ-1 基因突變會造成隱性遺傳帕金森病 (autosomal recessive PD);其他如 DNAJC1、ATP13A2、PLA2G6、VPS35 等基因上產生突變也會造成罕見形式的帕金森病。
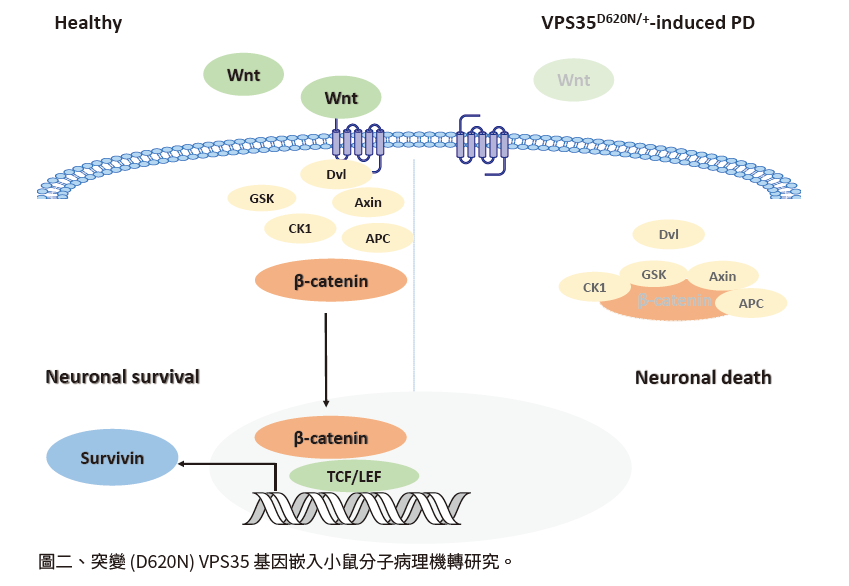
研究報導發現 VPS35 基因上 (D620N) 突變會造成第十七型遺傳型顯性帕金森病[7,8]。利用突變 (D620N) VPS35 基因嵌入小鼠,能應用研究帕金森病分子病理機轉[9]:在病理研究方面,發現突變 (D620N) VPS35 基因嵌入小鼠,在小鼠 16 個月大時可觀察到中腦黑質多巴胺神經元之死亡,並呈現運動功能異常。在訊號傳遞研究方面,發現突變 (D620N) VPS35 基因會影響 Wnt/β-catenin 訊息傳遞路徑活性:突變 (D620N) VPS35 基因嵌入小鼠腦部 β-catenin 蛋白質量明顯減少,進而造成 survivin 基因表現減少,降低多巴胺神經元的存活 (圖二)。
小鼠模式的研究限制
小鼠在神經退化的研究上也是具有些缺點:在預測治療效果方面,無法完全準確預測藥物在人體的治療情況和效果。在模擬疾病病理特徵方面,由於小鼠生命週期較短,可能無法呈現和人類在老化過程中神經退化的病理特徵。在疾病症狀方面,基因突變所造成人類疾病,在大鼠與小鼠中無法呈現臨床症狀或是只是呈現輕微的症狀。人類和齧齒類在基因上雖具有高度相似性,但仍存在許多差異,與神經退化有關的 RNA-binding proteins 在人類和齧齒類動物的結合位置序列則不盡相同。
未來發展
利用基因轉殖小鼠或是基因編輯小鼠的完整且複雜的神經系統,有助於治療方法和藥物開發,雖無法完全準確預測藥物在人體的治療情況和效果,但能模擬藥物對神經系統的作用,建立神經退化疾病小鼠模式對未來開發神經退化疾病相關藥物具有相當大的幫助與重要性。
參考文獻
- Blauwendraat C, Nalls MA, Singleton AB. The genetic architecture of Parkinson’s disease.
- Chiu CC, Weng YH, Huang YZ, Chen RS, Liu YC, Yeh TH et al. (D620N) VPS35 causes the impairment of Wnt/beta-catenin signaling cascade and mitochondrial dysfunction in a PARK17 knockin mouse model. Cell Death Dis 2020; 11: 1018.
- Dawson TM, Golde TE, Lagier-Tourenne C. Animal models of neurodegenerative diseases. Nat Neurosci 2018; 21: 1370-1379.
- Drummond E, Wisniewski T. Alzheimer’s disease: experimental models and reality. Acta Neuropathol 2017; 133: 155-175.
- Esquerda-Canals G, Montoliu-Gaya L, Güell-Bosch J, Villegas S. Mouse Models of Alzheimer’s Disease. J Alzheimers Dis 2017; 57: 1171-1183.
- Lewandowski CT, Maldonado Weng J, LaDu MJ. Alzheimer’s disease pathology in APOE transgenic mouse models: The Who, What, When, Where, Why, and How.
- Vilariño-Güell C, Wider C Fau – Ross OA, Ross Oa Fau – Dachsel JC, Dachsel Jc Fau – Kachergus JM, Kachergus Jm Fau – Lincoln SJ, Lincoln Sj Fau – Soto-Ortolaza AI et al. VPS35 mutations in Parkinson disease.
- Wang HL, Lu CS, Yeh TH, Shen YM, Weng YH, Huang YZ et al. Combined Assessment of Serum Alpha-Synuclein and Rab35 is a Better Biomarker for Parkinson’s Disease. J Clin Neurol 2019; 15: 488-495.
- Zimprich A, Benet-Pagès A Fau – Struhal W, Struhal W Fau – Graf E, Graf E Fau – Eck SH, Eck Sh Fau – Offman MN, Offman Mn Fau – Haubenberger D et al. A mutation in VPS35, encoding a subunit of the retromer complex, causes late-onset Parkinson disease.