癌症研究和治療- 源自患者的異種移植 (PDX) 小鼠模型
蔡寧遠 獸醫師
樂斯科生技(股)公司 副總經理
由於大多數晚期癌症無法治癒,對開發新治療方式是必需的。有許多癌細胞系發展,長期被用於基礎和臨床前的癌症研究。然而,由於人造的培養條件,這些細胞系有它的缺點,它們不一定反映出患者中原始癌細胞的行為。因此,細胞系衍生的異種腫瘤移植模型,可以將癌細胞系移植到免疫功能低下的小鼠中,也可用於癌症研究。然而細胞系衍生的異種移植具有產生更接近腫瘤的生理和病理條件的微環境的優點,但還是有缺點,其所使用的癌細胞可能已經在體外適應生長而失去了一些原始特徵。
近年來,患者來源的異種移植(PDX)小鼠模型引起關注,目的是解決這些問題。藉由將患者衍生的腫瘤碎片直接植入免疫缺陷小鼠中建立 PDX 小鼠模型,由於 PDXs 被認為保留了與原始腫瘤非常接近的形態、結構和分子特徵,因此它們具有基礎和臨床前癌症研究的潛力 [1],可用於生物標靶發現,個人化藥物篩選,了解抗藥機制及發展新的療法。
PDX模型的特徵
事實上,已有一些 PDX 模型被報導,各自研究小組有自己的方法來提高PDX 植入的成功率,儘管這些報導似乎有著共同的基本概念和技術。簡而言之,從手術或活組織檢查取得的腫瘤組織中收集實體腫瘤或是單細胞懸浮液,在皮下植入(皮下移植),或與患者原始腫瘤相同的器官植入(原位移植),或植入免疫缺陷小鼠的腎囊中。皮下移植模型可見細胞轉移,能精確監測腫瘤形成和生長,但相較之下,原位 PDX 模型移植腫瘤的微環境可能與患者的原始腫瘤的微環境更相似,移植技術和監測腫瘤生長比皮下模型更為困難。據研究,原位 PDX 模型與皮下模型相比,移植胰腺腫瘤轉移的發生率增加 [2]。
關於 PDX 模型中腫瘤細胞是否顯示與原始腫瘤相似的特徵,已經有很多文獻探討證明。例如,利用人乳腺癌細胞系,通常轉移不良,但如利用患者原始腫瘤,大多數乳腺癌 PDX 則能顯示出轉移 [3]。而在形態學方面,細胞和結構特徵,各種腫瘤在 PDX 模式中可以得到很好的維持4。此外,據報導 PDXs 與原始的癌症比較,保留基因組改變和基因表達的輪廓 [4,5]。然而,值得注意的是,最近有人提出 PDXs 顯示一些基因組株落選擇,比以前認為的基因組較不穩6。例如,Ben-David 等人。分析了 24 種癌症 PDX 繼代過程中 DNA 複製數改變的動態變化 [7]。儘管總體相似,但 PDX 模型的複製數改變情況逐漸偏離原始原發腫瘤,是不是因為這種選擇壓力造成尚不清楚。
PDX 似乎是癌症研究一個有潛力的模型,儘管它有一些局限性但還是很重要。在原始腫瘤組織中,基質細胞如上皮細胞和纖維細胞與癌細胞共存,但在 PDX 模型中,幾乎所有源自人腫瘤的基質細胞,不能持續增殖並被受體小鼠的細胞取代。因此,即使使用 PDX 模型研究腫瘤微環境還是存在不可避免的局限性。事實上,使用免疫檢查點抑製劑藥物,進行癌症免疫治療的效果評估,難以用移植到這些免疫缺陷小鼠中的PDX進行評估 [8]。主要是因 PDX 模型必須使用免疫缺陷小鼠來預防針對異種移植腫瘤的免疫攻擊。而由於免疫系統失去能力,缺乏與腫瘤微環境相互作用的關鍵部分,影響在 PDX 模型中研究的免疫療法和抗癌劑。於是研究人員開始探索人源化異種移植模型進行免疫研究。建立具有免疫力的 PDX 模型小鼠,對於研究癌症免疫療法可能更為重要的。透過將患者腫瘤片段和外周血或骨髓細胞共同移植到 NOD / SCID 小鼠中來產生人源化異種移植模型。共同植入允許重建小鼠免疫系統的細胞,從而深入了解異種人的基質與癌症進展和轉移中的腫瘤環境之間的相互作用。然而,這些策略尚未針對大多數腫瘤類型進行驗證,並且仍然存在關於重建的免疫系統是否將以與患者相同的方式表現的問題。例如,由於以與移植物抗宿主病相似的方式暴露於小鼠組織,免疫系統可能“超活化的”產生其他的影響,目前已經有了用於急性淋巴細胞白血病和急性髓性白血病的人源化異種移植模型。
PDX 模型在基礎和臨床前癌症研究中的應用
PDX 模型在基礎研究中的應用之一可能是闡明治療機制,以及辨別癌症的靶標或生物標記物。例如,Das Thakur 等人,研究顯示,對 BRAF 抑製劑 vemurafenib 耐藥的細胞也對兩種黑素瘤 PDX 模型顯示藥物依賴性,但由於連續 vemurafenib 治療產生抗藥性,但隨抗藥細胞被找出,產生了一潛在的治療策略,透過改變 BRAF 突變黑素瘤患者的劑量來預防抗藥性的出現9。另外,趙等人,通過 qPCR 分析篩選癌症幹細胞標記,並報導在肝細胞癌患者和 PDX 模型中觀察到 CD133 / CD44 表達的預期的高度一致性 [10]。這些在臨床前 PDX 模型的應用可以說很有價值,因為它們可以節省臨床評估所需的時間和成本。
PDX 模型的另一個應用是通過在臨床前模型中篩選藥物來訂定個體化醫療的治療策略。儘管從腫瘤組織中分離的癌細胞已被直接用於抗癌藥物篩選,但它們在預測臨床反應方面的準確有限。然而,PDX 模型可用作個體化癌症治療藥物篩選出更可靠的“替代藥”。例如,Hidalgo 等,建立了 14 例患者的胰腺 PDX 模型,並在 232 種治療方案中篩選出 63 種抗癌藥物。在確定 PDX 模型中最有效的治療後,對 11 名患者進行了 17 種的試驗,其中 15 種治療中可檢測到緩解。這種篩選藥物的策略似乎非常有效和有希望,儘管它有時可能有局限性。
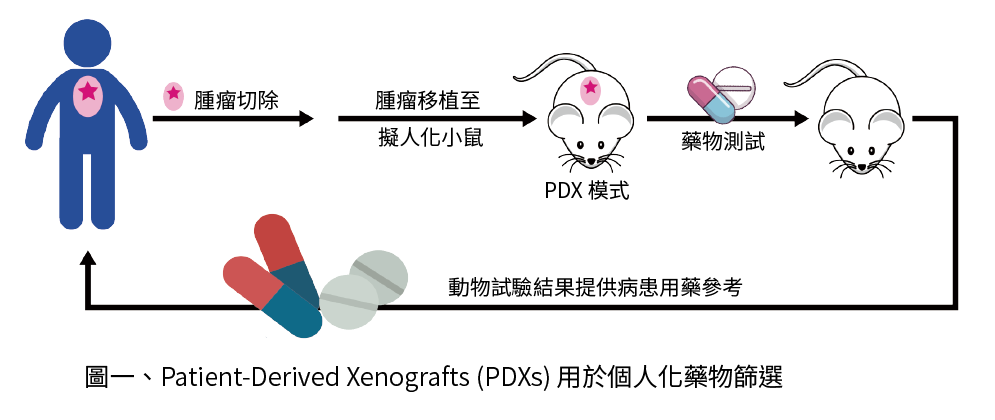
事實上,依據腫瘤類型或切除植入的患者組織中癌細胞的百分比不同而有所不同11,所以建立 PDX 模型通常需要幾個月(4-30 週,平均時間為 14 週),且需仰賴受體小鼠,目前如何縮短這時間則為研究者努力的目標。此外,據報導,建立 PDX 的成功率也在 23% 至 75% 之間 [12]。因此,儘管正在進行臨床試驗,但仍然存在些困難來為患者篩選個體化合適藥物。
未來的觀點
PDX 在冷凍條件下可作為腫瘤生物庫儲存,一旦實驗需要,就可立即用於再移植和擴展。甚至有些源自患者的原始腫瘤的大小太小,可藉 PDX 模型,將腫瘤植入免疫功能不全的小鼠中擴展到更大的體積。因此,大量不同的 PDX 模型使我們能夠有效、精確地測試抗癌藥物。實際上,通過使用許多不同的 PDX 模型一次篩選一些藥物,而這些 PDX 模型可以保留源自不同患者的不同腫瘤的特異性特徵。因此,成立 PDX 生物庫可以成為臨床前癌症藥物基因組學研究的有力來源。
近來,已經建立了許多研究合作的 PDX 網絡銀行。例如,EurOPDX 為非營利目的的研究機構的科研網絡(http://europdx.eu/)13。他們分享了來自 30多種不同實體腫瘤類型的 1500 多種 PDX 模型,以及它們的特徵訊息。例如,Bruna 等,在該生物庫中充分利用了乳腺癌 PDX 模型,並製備了用於培養的 PDX 衍生的腫瘤細胞,保留了原始 PDX 的特徵。他們也開發了一個藥物篩選試驗平台,用 PDX 衍生的腫瘤細胞,來評估和驗證藥物反應。考慮到 PDX 網絡銀行的這種應用,將有更多用於基礎和臨床前研究的 PDX 模型被關注。
參考文獻
- Refer to Use of patient-derived xenograft mouse models in cancer research and treatment. Future science OA, Mar 4(3)
- Cho SY, Kang W, Han JY, et al. An integrative approach to precision cancer medicine using patient-derived xenografts.Mol. Cells.2016;39(2):77–86.
- Fu X, Guadagni F, Hoffman RM. A metastatic nude-mouse model of human pancreatic cancer constructed orthotopically with histologically intact patient specimens.Proc. Natl Acad. Sci. USA.1992;89:5645–5649.
- DeRose YS, Wang G, Lin YC, et al. Tumor grafts derived from women with breast cancer authentically reflect tumor pathology, growth, metastasis and disease outcomes.Nat. Med.2011;17(11):1514–1520.
- Chijiwa T, Kawai K, Noguchi A, et al. Establishment of patient-derived cancer xenografts in immunodeficient NOG mice.Int. J. Oncol.2015;47(1):61–70.
- Gao H, Korn JM, Ferretti S, et al. High-throughput screening using patient-derived tumor xenografts to predict clinical trial drug response.Nat. Med.2015;21(11):1318–1325.
- Eirew P, Steif A, Khattra J, et al. Dynamics of genomic clones in breast cancer patient xenografts at single-cell resolution.Nature.2015;518(7539):422–426.
- Ben-David U, Ha G, Tseng YY, et al. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat. Genet. 2017;49(11):1567–1575.
- Hidalgo M, Bruckheimer E, Rajeshkumar NV, et al. A pilot clinical study of treatment guided by personalized tumorgrafts in patients with advanced cancer. Mol. Cancer Ther.2011;10:1311–1316.
- Das Thakur M, Salangsang F, Landman AS, et al. Modelling vemurafenib resistance in melanoma reveals a strategy to forestall drug resistance.Nature.2013;494:251–255.
- Zhao Q, Zhou H, Liu Q, et al. Prognostic value of the expression of cancer stem cell-related markers CD133 and CD44 in hepatocellular carcinoma: from patients to patient-derived tumor xenograft models.Oncotarget.2016;7:47431–47443.
- Hidalgo M, Amant F, Biankin AV, et al. Patient-derived xenograft models: an emerging platform for translational cancer research.Cancer Discov.2014;4:998–1013.
- Lai Y, Wei X, Lin S, et al. Current status and perspectives of patient-derived xenograft models in cancer research.J. Hematol. Oncol.2017;10(1):106.
- Byrne AT, Alférez DG, Amant F, et al. Interrogating open issues in cancer medicine with patient-derived xenografts.Nat. Rev. Cancer.2017;17:254–268.