毒蛇咬傷動物模式
陳俊魁 主治醫師
林口長庚醫院急診醫學科
劉建均 博士
長庚大學分子醫學研究中心
毒蛇咬傷
2017年世界衛生組織(World Health Organization, WHO)將毒蛇咬傷列入二十個被忽略的熱帶醫學疾病(Neglected tropical disease)當中,欲喚起世界對毒蛇咬傷的重視,並結合各界力量來有效控制此疾病的發生、降低醫療成本 [1]。根據WHO的粗略統計,每年約有五百四十萬人遭受到毒蛇咬傷,至少有八十一萬人因毒蛇咬傷而死亡,還有至少四十萬人因毒蛇咬傷造成終身殘疾 [2]。毒蛇咬傷最常發生的區域為東南亞、南亞、南美洲以及非洲東撒哈拉以南地,且毒蛇咬傷一直是當地相當重要的公共衛生議題。
目前,抗蛇毒血清施打還是唯一官方認可的臨床治療毒蛇咬傷方式,但此動物血清的治療方法一直以來存在著許多問題:(1)抗蛇毒血清治療常常引發一些不良反應,包含急性的全身性過敏反應(Severe anaphylactic reactions)和在施打幾天後才會發生的血清病(Serum sickness)等 [3, 4],全世界這些不良反應的發生率約10%,有些地區則高達50-87% [5-7],而台灣抗蛇毒血清的不良反應約在3% [8, 9];(2)抗蛇毒血清的保存不易,血清的主要成分為免疫球蛋白,即便像台灣血清為凍乾的形式,血清還是需要長期保存在低溫下。毒蛇多棲息於野外、山區,毒蛇咬傷病患大多需花較長時間才能到達醫療院所進行抗蛇毒血清治療,延遲治療時間,使蛇毒已對人體造成不可逆的傷害,即便再多打幾瓶血清也無法挽回;(3)抗蛇毒血清價格非常昂貴,在已開發國家美國,抗蛇毒血清治療是會傾家蕩產的天價,每瓶血清(CroFab)的醫療價高達一萬五千美元,近期美國新聞報導,毒蛇咬傷的醫療花費將近十五萬美元。而在台灣,去年(108年)抗蛇毒血清的健保價從原先一萬七千元漲至兩萬五千元,根據一次施打四至十瓶抗蛇毒血清的使用量來計算 [10, 11],每位毒蛇咬傷病患光血清藥物的健保成本就高達十萬至二十五萬元,為健保對國人平均每人每年支出的二至五倍。因此,為減低醫療成本和提升毒蛇治療效率與效果,擴展現有血清的交叉中和反應、發展新型毒蛇咬傷治療方法或輔助血清治療之方法皆是毒蛇咬傷研究的重要目標。
雖然現在有許多生化試劑可以來檢測評估蛇毒的活性,像是磷脂酶A2活性、凝集活性以及水解蛋白活性等,但蛇毒對於人體的傷害其實比想像中還要複雜許多,難以單從生化試驗或細胞模式來模擬臨床情形,在生化特性測試後,還是需要以動物實驗來模擬蛇毒以及藥物在活體生物體內的環境中的反應,來評估蛇毒毒性與試驗藥物之藥效。蛇毒的致死性動物模式最常被科學家使用,然而因實際臨床所引發的特殊症狀,WHO也針對各種蛇毒毒性的動物模式提出指引 [12],在此則針對與台灣蛇毒較為相關的致死性與組織壞死性動物模式進行介紹。
建立毒蛇咬傷動物模式與藥物篩選評估- 蛇毒致死性(lethality)之動物模式
以蛇毒的致死性來評估藥物治療效果是研究學者最普遍使用的方法,主要因為致死性的動物模式建立最為方便,且死亡為各蛇毒蛋白質毒性的最後綜合結果,在對蛇毒生理病理作用還尚未完全了解前,針對蛇毒的致死性為最直接之方法。在測試藥物對蛇毒的中和效果前,需先了解蛇毒對小鼠的致死效力,如同大多數的毒物,蛇毒也是用半數致死劑量(median lethal dose, LD50 )來描述在小鼠身上之致死效力。而根據WHO的指引 [12],在蛇毒的LD50上,建議每一劑量實驗組使用五隻以上的小鼠來進行試驗,結果才會有統計意義,若在初期試驗階段,對蛇毒致死劑量尚未有預期的範圍時,為了避免小鼠無謂的犧牲,建議先進行劑量範圍限縮實驗(Range-finding test),每一劑量實驗組只用一隻小鼠,找出小鼠致死與存活的蛇毒劑量最小範圍,侷限在特定劑量範圍後,再進行較大規模的動物試驗,找出蛇毒的LD50。在確認蛇毒的LD50後,則以三至六倍的LD50當作致死劑量來建立蛇毒致死性的動物模式,用以測試試驗藥物是否有中和蛇毒毒性,而藥物的中和效力則以半數有效劑量(median effective dose, ED50)來定量藥物的保護效果,作為未來用於臨床實驗的參考指標。
而蛇毒致死性的動物模式中,蛇毒與藥物的注射方式是影響試驗結果很重要的因素,不同的注射路徑會影響蛇毒的毒性作用與使用劑量,實際操作時可能因不同的蛇毒性質而有所改變,例如:雨傘節蛇毒屬神經性毒性作用,致死性較其他出血性蛇毒強,若以腹腔或靜脈注射方式可能使蛇毒快速擴散接觸到呼吸道平滑肌與其神經,導致呼吸衰竭致死,進而使死亡時間過短所得到的數據不穩定,另外,雨傘節的毒牙為勾牙狀,長度較短,在實際蛇咬之情況下大多只注射置皮下位置,因此,雨傘節咬傷的動物模式會採用皮下注射,使蛇毒透過擴散緩慢進入小鼠體內,使小鼠不會突然猝死,實驗數據較為穩定;而龜殼花與赤尾青竹絲的蛇毒屬於出血性蛇毒,這類型的蛇毒則大部分使用腹腔或靜脈注射來建立致死性的動物模式,若使用皮下注射的方式常會發生施打到很高的蛇毒劑量,但小鼠還尚未死亡的情況。另一方面,注射方式也會影響小鼠存活率的觀察時間點,根據WHO的建議,靜脈與皮下注射為觀察小鼠在施打後二十四小時的存活率來計算LD50,而腹腔注射的方式則須延長觀察時間至四十八小時。而在試驗小鼠的品系選擇上,並未有嚴格的規定,但建議使用遠交系小鼠來進行,減少研究結果是因特定基因背景所產生之情況發生。
組織壞死性 (necrosis) 之動物模式
蛇毒會造成非常多樣的生理病理症狀,像是凝血異常、呼吸衰竭、腎衰竭、組織壞死等,因此,WHO建議新型血清或藥物在臨床前試驗階段,除了以致死性來測試療效外,也可針對各蛇毒所引發的臨床病理症狀進行評估。組織壞死是蛇毒會引起的重要臨床症狀之一,此病理現象雖不會造成死亡,但會對病患產生永久性的傷害。因此,在進行會引發組織壞死蛇毒的相關研究,除了基本的致死性動物模式,組織壞死性動物模式的建立也是相當重要的。而組織壞死性的評估則是將蛇毒以皮內注射的方式打到小鼠之後頸部,於七十二小時後,將小鼠犧牲並取下後頸部之皮組織,觀察皮膚內層組織壞死情形(圖一)。組織壞死性的強弱則是以蛇毒最小壞死劑量(minimum necrotizing dose, MND)來表示,定義為能造成直徑5毫米的組織壞死圈之蛇毒劑量。而組織壞死性的動物模式,WHO則建議使用一至兩倍的MND來建立,觀察新型血清或藥物對小鼠身上之組織壞死圈大小的影響來判斷其針對組織壞死性之中和效力。在針對組織壞死性之中和效力的計算與ED50相似,評估的單位為組織壞死性的半數有效劑量(MND-median effective dose, MND50),定義為組織壞死圈直徑縮減一半之血清或藥物劑量。
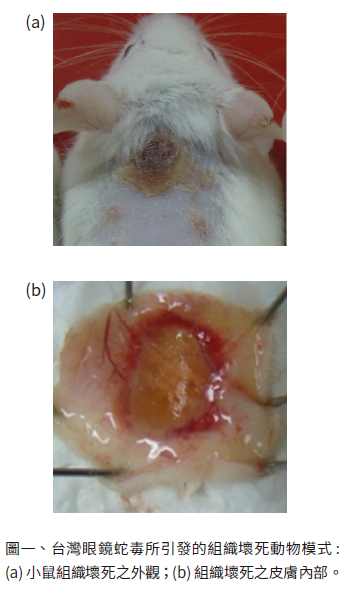
某些蛇毒的毒性成分較為特殊,組織壞死性的動物模式並無法順利建立,此類蛇毒在高劑量時,會使小鼠未到七十二小時的觀察時間點即提早死亡,而未造成小鼠死亡的劑量又無法引發組織壞死的病理現象發生,如非洲地區的兩種眼鏡蛇(Naja pallida和Naja nubiae)就無法成功建立組織壞死性的動物模式 [13],推測可能原因為此類眼鏡蛇蛇毒中含有的神經性毒蛋白質過多或毒性過強,導致全蛇毒在低劑量時,神經性毒性就足以導致小鼠死亡,無法對組織壞死性有進一步的觀察。台灣眼鏡蛇(Naja atra)也有同樣的現象,無法以全蛇毒建立組織壞死之動物模式,而針對這樣的情況,先前研究則是先將台灣眼鏡蛇蛇毒分離純化,找出主要引發組織壞死之毒性蛋白質,以其建立組織壞死動物模式來評估現行血清對眼鏡蛇蛇毒所引發之組織壞死是否有抑制效果 [14]。
因組織壞死不會導致死亡,在早些抗蛇毒血清發展時期常被忽略,鮮少有人針對此症狀進行探討。直到近期,WHO將組織壞死動物模式標準化,許多研究團隊才開始評估傳統以動物生產的抗蛇毒血清對蛇毒引發的組織壞死有沒有中和效力 [13-16],發現許多現行的抗蛇毒血清對蛇毒引發之組織壞死是沒有抑制效果的,其中也包括台灣的現行血清,台灣已使用多年的抗神經性血清對台灣眼鏡蛇所引發之組織壞死是沒有中和效果的,這可能也是台灣因眼鏡蛇咬傷病患高達60 %需要進行手術清創傷口的主因。未來,許多研究單位可能會針對眼鏡蛇引發的組織壞死發展新型的藥物或治療方式,此組織壞死動物模式將會成為很好的研究工具,被用於中和效力之評估。
總結
蛇毒相關研究已有多年歷史,多種蛇毒動物模式所使用的劑量、注射方式、動物品系等都有文獻可尋,可節省建立所需的人力與時間,減少動物的使用。而除了蛇毒致死性的動物模式外,可針對研究蛇毒特別引發的病理症狀建立動物模型,以利更深入的研究。毒蛇咬傷的動物模型,對於蛇毒本身的研究以及後續的藥物開發,都具有極大的重要性,毒蛇咬傷的小鼠動物模型等於一個穩定的生物體藥物篩選平台,提高藥物未來在人體試驗時的可行性及安全性,更能夠加速蛇毒相關的研究發展。
- Williams DJ, Faiz MA, Abela-Ridder B, Ainsworth S, Bulfone TC, Nickerson AD, et al. Strategy for a globally coordinated response to a priority neglected tropical disease: Snakebite envenoming. PLoS Negl Trop Dis. 2019;13(2):e0007059.
- Kasturiratne A, Wickremasinghe AR, de Silva N, Gunawardena NK, Pathmeswaran A, Premaratna R, et al. The global burden of snakebite: a literature analysis and modelling based on regional estimates of envenoming and deaths. PLoS Med. 2008;5(11):e218.
- Leon G, Herrera M, Segura A, Villalta M, Vargas M, Gutierrez JM. Pathogenic mechanisms underlying adverse reactions induced by intravenous administration of snake antivenoms. Toxicon. 2013;76:63-76.
- de Silva HA, Ryan NM, de Silva HJ. Adverse reactions to snake antivenom, and their prevention and treatment. Br J Clin Pharmacol. 2016;81(3):446-52.
- Sharma SK, Alirol E, Ghimire A, Shrestha S, Jha R, Parajuli SB, et al. Acute Severe Anaphylaxis in Nepali Patients with Neurotoxic Snakebite Envenoming Treated with the VINS Polyvalent Antivenom. J Trop Med. 2019;2019:2689171.
- Vongphoumy I, Chanthilat P, Vilayvong P, Blessmann J. Prospective, consecutive case series of 158 snakebite patients treated at Savannakhet provincial hospital, Lao People’s Democratic Republic with high incidence of anaphylactic shock to horse derived F(ab’)2 antivenom. Toxicon. 2016;117:13-21.
- Otero R, Gutierrez JM, Rojas G, Nunez V, Diaz A, Miranda E, et al. A randomized blinded clinical trial of two antivenoms, prepared by caprylic acid or ammonium sulphate fractionation of IgG, in Bothrops and Porthidium snake bites in Colombia: correlation between safety and biochemical characteristics of antivenoms. Toxicon. 1999;37(6):895-908.
- Chen JC, Bullard MJ, Chiu TF, Ng CJ, Liaw SJ. Risk of immediate effects from F(ab)2 bivalent antivenin in Taiwan. Wilderness Environ Med. 2000;11(3):163-7.
- Mao YC, Liu PY, Chiang LC, Lai CS, Lai KL, Ho CH, et al. Naja atra snakebite in Taiwan. Clin Toxicol (Phila). 2018;56(4):273-80.
Ho CH, Mao YC, Tsai YD, Lin CS, Liu SH, Chiang LC, et al. Descriptive study of snakebite patients in Northern Taiwan: 2009 to 2016. J Med Sci. 2019: 39:114-20. - Mao YC, Liu PY, Chiang LC, Lai CS, Lai KL, Ho CH, et al. Naja atra snakebite in Taiwan. Clin Toxicol (Phila). 2017:1-8.
WHO Guidelines for the Production, Control and Regulation of Snake Antivenom Immunoglobulins (https://www.who.int/bloodproducts/snake_antivenoms/snakeantivenomguide/en/) - Petras D, Sanz L, Segura A, Herrera M, Villalta M, Solano D, et al. Snake venomics of African spitting cobras: toxin composition and assessment of congeneric cross-reactivity of the pan-African EchiTAb-Plus-ICP antivenom by antivenomics and neutralization approaches. J Proteome Res. 2011;10(3):1266-80.
- Liu CC, Chou YS, Chen CY, Liu KL, Huang GJ, Yu JS, et al. Pathogenesis of local necrosis induced by Naja atra venom: Assessment of the neutralization ability of Taiwanese freeze-dried neurotoxic antivenom in animal models. PLoS Negl Trop Dis. 2020;14(2):e0008054.
- Rivel M, Solano D, Herrera M, Vargas M, Villalta M, Segura A, et al. Pathogenesis of dermonecrosis induced by venom of the spitting cobra, Naja nigricollis: An experimental study in mice. Toxicon. 2016;119:171-9.
- Gutierrez JM, Rojas E, Quesada L, Leon G, Nunez J, Laing GD, et al. Pan-African polyspecific antivenom produced by caprylic acid purification of horse IgG: an alternative to the antivenom crisis in Africa. Trans R Soc Trop Med Hyg. 2005;99(6):468-75.