次世代 3D 病理檢測暨 AI 影像分析系統
林奇佑 博士
捷絡生物科技股份有限公司
癌症已成為全球人口的第二大死因,每年新發生之罹癌人數與死亡人數均持續攀升,為解決尚未滿足的醫療需求,開發新治療方法及診斷工具成為首要之務。在診斷為良性或惡性腫瘤的過程中,通常由病理醫師檢視外科手術切除的器官或組織之單一切片。因此,傳統病理檢驗不僅時程較長,其資訊量與精準度亦有限,且不同醫師或醫療機構間的判讀亦不盡相同,造成後續診斷與治療的困難。3D 數位影像系統藉由創新的病理組織處理、高速影像掃描及AI 輔助分析系統,可取得更完整的立體組織數位影像,使不同醫師獲得相同的組織結構細節資訊,突破傳統病理切片判讀取樣低、步驟繁複等問題,輔助臨床醫師精準診斷癌症,並做出更好之臨床決策。「3D腫瘤影像系統」呈現之完整病理組織,包含: 組織澄清 (Tissue Permeabilization) 技術、高速3D數位病理組織掃描器 (High speed 3D digital pathology scanner) 與人工智慧圖像分析 (Artificial intelligence analysis) (圖一)。 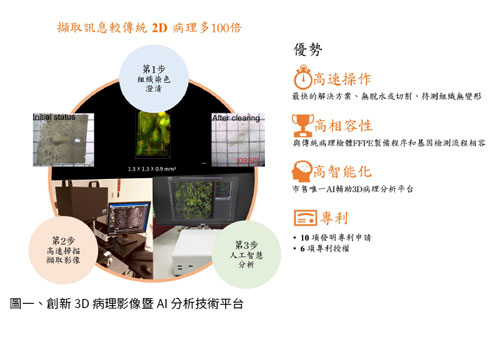
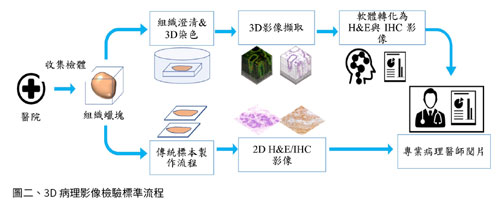
2D 與 3D數位病理檢測之完整標準驗證流程,如圖二所示。由醫院取得之檢體將分兩組處理,2D病理實驗組係依照傳統病理標本製作流程擷取薄切片、染色後由病理師以顯微鏡閱片,再提供專業判讀診斷。3D病理實驗組經染色與組織澄清液處理後,使用高速影像掃描器擷取3D螢光染色影像、轉化影像資訊為H&E或IHC色系、並導入AI分析,最後交由病理醫師閱片判讀及進行2D-3D影像交叉比對,可讓病理師和腫瘤科醫師了解詳細的檢體資訊,據以規劃治療策略。癌症診斷也有同樣的痛點,放射科影像進行腫瘤診斷,僅可提供醫師mm等級的結節,但是無法知道其中細胞核的大小及變異,因此若要進一步確認結節的狀況,就必須進行切片檢查。目前的切片技術取出1 mm直徑的樣品,但是只能用5 μm (約200分之一)單層細胞進行薄切片診斷,導致無法呈現細胞之間的作用及微環境變化。在傳統立體組織影像擷取方面,利用各種染色方式配合石蠟包埋多重切片的方法解構三維的組織形狀是目前病理師可進行的設計,但是此種方式在刀片切削面的組織型狀難免被擠壓破壞,導致影像資訊不全或影像重組困難。目前利用共軛焦顯微鏡設備,以針孔過濾焦平面資訊結合雷射激發光源掃描取像的虛擬切片,成為主流的三維生物組織重組觀察的方式。臨床組織學的應用仍需考慮:影像擷取速度不足與光學顯微鏡視野受限等問題。因此,利用震盪式掃描進行影像擷取加速取像及自動化影像拼合技術應運而生,可解決視野受限的問題。由於3D病理影像檢測掃描細緻,每個檢體可產出terabyte (TB)等級的巨量數位影像資訊,所以需要應用電腦輔助相關人員進行影像的讀取及分析。
大量的數據雖然可提供更多的資訊,讓相關診斷的精準度大幅提高,但是考量到工作量提升造成病理檢驗人員判斷力的下降,所以運用AI及3D影像的結合,才能真正地帶來進一步組織判讀的新應用。 市場中,捷絡生技建立之AI模型係採用監督式語意分割(supervised semantic segmentation)方法,改進HRnetV2網絡的速度及規模,累積約50至100張病理專家標註的高解析度3D病理影像即可建構AI模型。此創新的分割模型可支援以像素(pixel)級解析度的影像特徵分析。
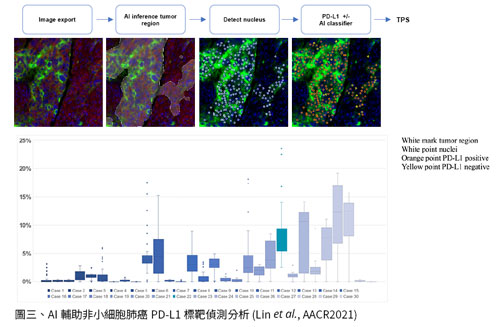
以非小細胞肺癌為例,現行臨床肺癌治療使用免疫檢查點抑制劑 (immune checkpoint blockade therapy)前,需要病理診斷標靶分子細胞程式死亡配體-1 (Programmed Death Ligand; PD-L1)的表現量,並依據腫瘤區域之PD-L1表現百分比數值(Tumor Proportion Score、TPS)高低選擇適當的用藥策略。近期回溯性臨床研究分析30個150 μm厚的肺癌蠟塊檢體,以創新的技術可連續每1 μm掃描一張病理影像,得到約TB規模的細胞型態與PD-L1染色影像巨量資訊。如此龐大的數據遠超過傳統病理醫師可判讀的數量及一般電腦的運算,因此需要將影像存到雲端並開發AI輔助分析軟體以協助精準定量與比較分析。
首先輸入30例肺癌檢體影像資訊即開發兩種AI模型,第一種可辨識腫瘤區域,可自動圈選每張影像中的肺癌細胞部位(圖三上左、白色圈選區);第二種則可分類PD-L1陽性訊號出現於膜的細胞(圖三上右、橘色圓圈),將同一片影像的後者數值除以前者數值即得到以新穎3D病理方法計算的TPS值(3D TPS)。接著一一分析30個肺癌檢體,將每一層的TPS值加總平均成為3D TPS數值,並以四分衛數方式呈現柱狀圖(圖三下)。結果顯示共15個檢體之3D TPS小於1%,表示這些病人屬於不適合用藥組;另外15個檢體的3D TPS則高於1%門檻,表示這些病人有機會為適合用藥組。然而,以傳統的2D TPS方法計算顯示其中24個檢體之PD-L1 TPS均低於1%,僅6個檢體之PD-L1 TPS高於1%。兩相比較,以AI輔助3D病理影像分析可取得完整的PD-L1染色資訊,提升PD-L1診斷的陽性率、發現更多病人符合現行用藥標準,有機會及早用藥。由於腫瘤的異質性(heterogeneity)造成PD-L1在肺癌細胞膜表現分布不均,單一切片的診斷不足以代表完整檢體特性,3D病理影像技術可解決患者找不到藥、新藥找不到患者的問題。
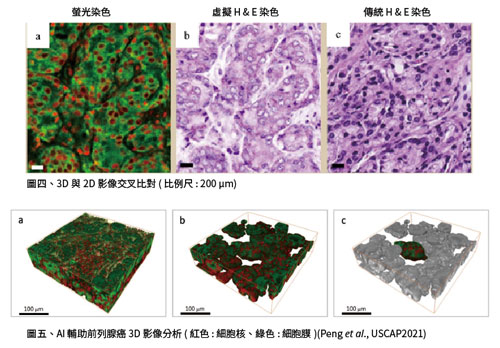
格里森分級系統 (Gleason grading system) 為前列腺癌病理分級中最常使用的標準。臨床病理醫師檢視腫瘤組織切片時,依據癌細胞分化的情況及其佔的範圍決定評分,分數越高代表腫瘤分化越差、分數高低也會同時影響病人後續的治療方針。為了幫助臨床病理醫師快速熟悉創新技術的應用,創新的分析軟體可將螢光染色轉換成傳統H&E或IHC染色結果,方便進行快速判讀以呈現完整與精確的病理組織特徵 (圖四)。 運用專利3D影像技術同時結合AI判讀,可完整呈現立體前列腺癌腫瘤型態,特別是管腔 (lumen)結構的變化(圖五)為醫師提供更完整資訊,降低誤判風險。上述多項研究成果顯示3D數位病理影像的優越性及發展潛力。