實驗大小鼠疼痛管理
梁鍾鼎 首席科學家
諾和諾德 中國研發中心
疼痛一般分成三大類,(1). Nociceptive:有明顯的組織傷害,通常是急性,當組織癒合或刺激停止後疼痛反應緩解。(2). Neuropathic:當疾病或傷害影響到軀體感覺神經系統,引起疼痛,通常是慢性。(3). Neuroplastic:這一類最難控制,當某原因影響生物體,使其神經系統改變,去啟動疼痛的異常訊號,但卻沒有實際的組織傷害。此類疼痛,不易判定其疼痛緩解的時間,也比較不易找出其原因,對症下藥 (Larson CM, 2019)。這類疼痛最難建立動物模式。 早期的論文並沒有將第 2、3 類分開分類,而概括為神經性疼痛 (neuropathic) 或慢性疼痛 (chronic)。
實驗動物疼痛管理是一個常常被忽略的問題,原因很多。報告指出2011~2015年間,計 400 篇牽涉到各類手術的論文中,文中提到任何麻醉或止痛劑的章節視為發表資訊完整 (publication completeness, PC),僅有 338 篇。在此 338 篇 SCI 論文中,僅有98篇提到術後止痛劑使用 (29%,98/338)。換句話說,有 71% 進行動物手術的論文沒有說明任何術後止痛劑的使用 (Carbone L, 2016)。
疼痛 (pain) 與緊迫 (distress) 常常伴隨一起,但我們要瞭解並非所有疼痛皆持續足夠的時間與強度引起緊迫。而緊迫的原因可能包含飢餓、口渴、社群隔離、或保定行為。而疼痛之最佳管理方式為給予止痛劑,但緊迫則需找出其原因 (Carbone L, 2019)。在疼痛管理的過程中有三個要素:(1). 獸醫師的專業判斷。(2). 對止痛劑使用是否會影響實驗數據的充分瞭解。(3). IACUC 委員、科學家、獸醫師之間在動物疼痛管理及科學結果間的平衡。舉一個例子,Meloxicam 在犬可能需要 0.1~0.2 mg/kg 皮下注射;但在小鼠則需要 2~5 mg/kg 皮下注射皆有報告,才能有止痛作用。所以不同品種之間,止痛劑量差異很大。
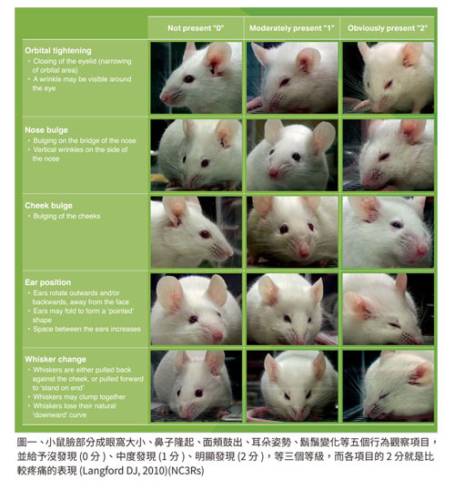
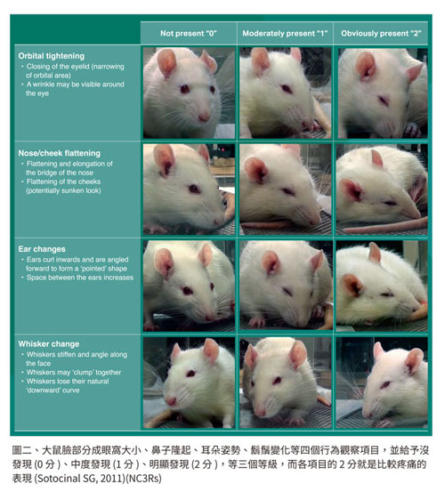
如何評估動物疼痛,尤其是鼠,更是一個挑戰。面部表情指標 (grimace scales) 將大小鼠臉部分成眼窩大小、鼻子隆起、面頰鼓出、耳朵姿勢、鬍鬚變化等四組五個行為觀察項目,並給予沒發現 (0 分)、中度發現 (1 分)、明顯發現 (2 分),等三個等級,而各項目的 2 分就是比較疼痛的表現 (Langford DJ, 2010; Sotocinal SG, 2011),雖然不盡完美,但這是一個簡易詳估大小鼠疼痛的方法。行為姿勢、面部表情、一般社群活動力、美容理毛行為、進食情況、挖洞做巢行為 ,皆可做為客觀評估標準。疼痛處理最好在急性期 (acute) 就能發現並治療。而且有一重要原則,不要只準備一種止痛藥,例如只有非類固醇抗炎症藥 (NSAID),用於所有手術後照顧及止痛 (Foley PL, 2019)。世界衛生組織應用於人類的疼痛緩解階梯策略 (Pain relief ladder),一樣可用於大小鼠。對疼痛處理相對更重視的寵物疼痛處理原則 (PLATTER),可以作為系統性評估方式,用於實驗大小鼠。換句話說,任何實驗計畫審查,如果涉及到外科手術或 USDA 等級 (D 或 E 等級),建議要有一個使用或不使用止痛劑的合理理由。用一個通俗的話,要將疼痛阻敵於境外,一旦進入動物體內,要徹底消滅。
另一個有趣的是報告提到一些止痛劑,例如 buprenorphine,tramadol,meloxicam,caprofen,ketoprofen,ibuprofen,acetaminophen,lidocaine,及 bupivacaine 等。如果依照一般指示,使用常用的劑量,例如 Meloxicam (5 mg/kg),很難達到小鼠術後止痛的效果,需要增加到 20 mg/kg;Buprenorphine 一天兩次注射,亦很難確保止痛期達 12 小時。所以在一些報告中建議小鼠 Buprenorphine (0.1~0.5 mg/kg),需要每 6 小時注射一次;Meloxicam (5~10 mg/kg),需要每 8~12 小時注射一次;Ketoprofen 需提高至 20 mg/kg,每 24 小時注射一次 (Foley PL, 2019)。有一些很貴的止痛劑對小鼠副作用大,不建議使用,例如 Ketorolac 4 mg/kg (Huang SW, 2010) 於小鼠;Ketoprofen 10 mg/kg 劑量太高 (Lamon TK, 2008) 於大鼠。
預先式止痛 (preemptive analgesia) 策略及止痛劑給予的時間點及方式非常重要。例如皮下或腹腔給藥,可能要注射後 15 ~ 30 分鐘才能達到治療濃度,口服給藥則須更久,動物可能有部分時間感到疼痛。NSAID 給藥需注意其高劑量易造成胃及十二指腸潰瘍,腎小管退行性變化,尤其是治療期超過三天或者動物已成脫水狀態下。肌肉注射方式盡量避免用於大小鼠,尤其是止痛劑呈酸性,易造成注射肌肉腫脹壞死。這些止痛劑的副作用,可以下列方式改善:(1). 使用兩種以上不同機制的止痛劑,而分別降低原來的初始劑量。(2). 局部及全身止痛劑同時使用。(3). 提供其它非藥物止痛的方式,例如軟而乾的紙質墊料、房間加溫、安靜不受打擾的鼠房、食物可以放於籠內及飲水可以輕易取得,不用站立或爬至籠頂蓋取得。(4). 必要時皮下或腹腔注射給予輸液乳酸林格氏液 (LRS),視體重小鼠給予 1 ~ 2 mL,大鼠給予 5 ~ 10 mL 不等 (Diehl KH, 2001)。動物疼痛控制是一個很大的學問,希望我們一起努力。
參考文獻
- Carbone L, Austin J. Pain and laboratory animals: publication practices for better data reproducibility and better animal welfare. PLoS ONE 11(5): e0155001. doi:10.1371, 2016.
- Carbone L. Ethical and IACUC consi-derations regarding analgesia and pain management in laboratory rodents. Comp Med 69(6): 443-450, 2019.
- Diehl KH, et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol 21:15-23, 2001.
- Foley PL, Kendall LV, Turner PV. Clinical management of pain in rodents. Comp Med 69(6): 468-489, 2019.
- Huang SW, et al. Case report: High mortality associated with Ketorolac treatment in CByB6F1 mice after embryo transfer surgery. Taiwan Vet J 36(4): 288-295, 2010.
- Lamon TK, Browder EJ, Sohrabji F, Ihrig M. Adverse effects of incorporating ketopro-fen into established rodent studies. JAALAS 47(4): 20-24, 2008.
- Langford DJ, et al. Coding of facial expre-ssions of pain in the laboratory mouse. Nature Methods 7(6): doi:10.1038/nmeth.1455, 2010.
- Larson CM, Wilcox GL, Fairbanks CA. The study of pain in rats and mice. Comp Med 69(6): 555-570, 2019.
- Sotocinal SG, et al. The rat grimace scale: a partially automated method for quantifying pain in the laboratory rat via facial expressions, Molecular Pain 7:55 http://www.molecularpain.com/content/7/1/55, 2011