實驗大小鼠健康監測及新興病原
梁鍾鼎 首席科學家
諾和諾德中國研發中心
當台大獸醫萬老師團隊 (Su CM et al., 2021) 發表星狀病毒 (MuAstV) 在台灣九個不同設施族群有7個呈陽性,陽性率達45.7% (48/105),我們推測新興病原可能就在實驗動物不同群落中流竄。這些盛行病原,因地區、年代、飼養方式及動物族群不同而異。例如近期阿根廷統計 2012-2016 年監測一般族群大小鼠,發現細菌陽性率最高為綠膿桿菌及變形桿菌 (Pseudomonas aeruginosa & Proteus sp.);寄生蟲陽性率最高為蟯蟲及三鞭毛蟲;病毒陽性率最高為小鼠肝炎病毒 (MHV)及大鼠冠狀病毒 (SDAV) (Carriguiriborde M et al., 2019)。有趣的是這10年後報告竟與台灣地區2004-2007年四年間調查病原陽性率非常類似。報告指出台灣地區小鼠盛行病原是小鼠肝炎病毒 (MHV),與小病毒 (MPV);大鼠盛行病原是黴漿菌 (Mycoplasma pulmonis),大鼠唾液腺淚腺炎病毒 (SDAV),蟯蟲及副黏液病毒 (PVM) (Liang CT et al., 2009)。同年在北美及歐洲發現大小鼠族群中一些新興病原陽性率非常高,例如小鼠諾華病毒 (MNV),陽性率達32.37%;螺旋桿菌(Helicobacter sp.),陽性率 16.08%;巴斯德嗜肺菌 (Pasteurella pneumotropica),陽性率 12.9%;三鞭毛蟲 (Trichomonads),陽性率 8.88%。
大鼠族群中以大鼠呼吸道病毒 (RRV),陽性率 6.36%;螺旋桿菌,陽性率 6.63%;金黃葡萄球菌,陽性率 23.61%;六鞭毛蟲 (Hexamastix sp.) 陽性率 4.6% 較高 (Pritchett-Corning KR et al., 2009)。
當我們分析實驗動物或基因操弄小鼠 (genetically engineered mice, GEM) 之表現型時,一定記得前提是遺傳及環境因素皆能影響動物的表現型分析,使得結果誤判。
例如當進行炎症性腸炎 (IBD) 研究時,其小鼠大腸炎病變的嚴重度不一定是真實的結果,反而和族群中小鼠是否感染螺旋桿菌 (Helicobacter spp.)有關。甚至研究肝炎、肝癌及腸癌的實驗,如果其動物模式選用免疫缺陷鼠如 Rag1/Rag2 及 Pkrdcscid小鼠時,易受螺旋桿菌感染的影響,此菌感染時分泌一種毒素 (cytolethal distending toxin, CDT),易加重動物肝及腸道癌症的發生 (Treuting PM et al., 2012)。
近年來一個令人聞之色變的小鼠諾華病毒 (MNV),沒有外表封套,可以在環境中存活時間較長,雖然其病變尚未明確,但此病毒可以和細小病毒 (MPV) 合併感染,所以被認為是 SPF 清單中要排除的項目。小鼠肝炎病毒 (MHV),不要忘了其陽性率非常高。可以只存在於免疫正常動物的腸道型,也可以感染呼吸道再散佈至動物其它系統的多發型,且前者傳染性更強。這些病毒 (例如 MHV,MNV,MPV) 皆可和螺旋桿菌合併感染。
如果將來有機會,我們再來介紹健康監測中的所用方法及技術,如何判定偽陽性、偽陰性及假的病變。此文以新興病原及監測項目為主。
有鑑於健康監測報告的格式及 SPF 項目的不一致,所以歐洲 FELASA 發表了更新的囓齒類實驗動物及兔子的健康監測參考標準 (Mahler M et al., 2014)。在這論文中,建議高風險族群或設施,例如每月皆引進動物;單位內有不同等級動物卻非常靠近;引進動物來源不止一個;動物常須移出動物房做實驗,但又移回來;動物房存放飼墊料的地方有野鼠及昆蟲可以出沒;經常接種生物材料於動物;多功能動物設施及多方面不同的實驗;經常有研究人員進出動物房;經常輪換單位動物照顧計畫 (ACP);有不易消毒的設備且常用,例如影像設備 (MRI, IVIS, Pet CT) 及行為學測試設備;這些為高風險因子,可以考慮增加某病原的檢測頻率。
低風險族群為封閉繁殖族群;一次全部清空的動物移動或實驗動物進出方式;動物引進不常見;動物實驗單純及少量。這種設施或族群可考慮延長健康監測的頻率。
在監測病原選擇,例如小鼠族群,以下項目為每季例行監測:病毒如MHV,MNV,MVM,MPV,GDVII 等;細菌例如螺旋桿菌、巴斯德嗜肺菌、B 溶血性鏈球菌及肺炎鏈球菌等。其他病毒可以考慮一年檢測一次,例如小鼠腺病毒(type Ⅰ & Ⅱ),LCMV,PVM, Sendai, Reo-3,及小鼠痘病毒 (Ectromelia virus) 等。細菌例如草酸桿菌亦可以年檢。內外寄生蟲也是季檢。其他的病毒及細菌可以考慮改為有狀況或特別族群才例行檢查。
例如肺囊蟲 (Pneumocystis muria vs carinii),此病原最早被認為是一種原蟲,但後來重新分類為黴菌 (Weisbroth SH, 2006),而且不只感染免疫缺陷動物,也會感染正常大鼠 (Fahey JR and Olekszak H, 2015) (Kim HS et al., 2014)。這種黴菌感染最初其組織病變也可能類似大鼠呼吸道病毒 (rat respiratory virus, RRV), 特徵為多發淋巴球性組織細胞間質性肺炎,經過鍍銀染色 (GMS) 及實驗接種證明為肺囊蟲。
這種黴菌感染,有時候其病變呈現泡沫狀,嗜伊紅性蜂窩狀結構出現於肺泡組織中,必須藉由 PCR 或特殊染色方式確診,但如果伴隨其他細菌或者嗜伊紅性巨噬細胞肺炎 (acidophilic macrophage pneumonia),易被忽略,特殊染色包括Wright’s stain, Romanowsky stain, Grocott’s methenamine stain (GMS) (Treuting PM et al., 2012)。
也有不同的聲音認為一味的強調健康監測排除的病原項目,有可能影響不同動物的腸道菌叢 (microbiota) 多樣性,進而使得疾病表現模型失敗,尤其是比較複雜的動物模式,是否考慮改變一成不變的健康監測策略,而能針對主要病原結合基因測序 (metagenomic-sequencing) 方法,使病原監測及腸道菌叢分析能同時進行,增加健康監測的意義 (Buchheister S and Bleich A, 2021)。
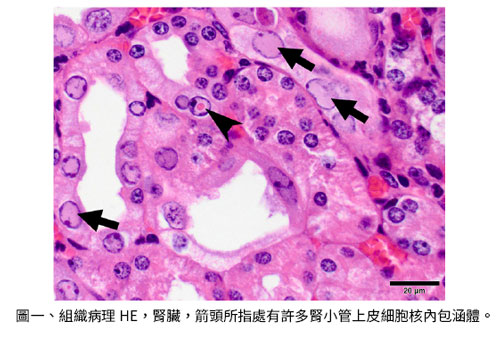
2018年我正在AALAS美國當地開會時,突然大會緊急宣布有一個新興病原發表演講臨時插入議程,於是許多實驗動物獸醫師都跑去那個會場,原來是頂尖期刊 (Cell) 發表了一篇 39 頁和新興小鼠病原有關的論文,一個被誤診近 40 年的病原。早期在小鼠腎臟看到腎小管細胞核有包涵體,皆認為可能是一種多囊瘤病毒 (Polyomavirus) 協同腎病,但是其真正病原沒有確診。
此報告利用各種分子病理診斷方法,證明為一種對腎臟有親和性的非典型細小病毒 (Roediger B et al., 2018),而且對免疫缺陷及基因操弄小鼠特別易感 (圖一)。
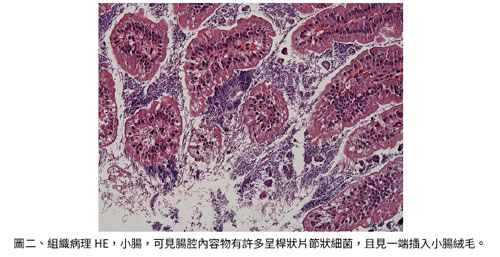
有一次,一個獸醫拿了一片免疫缺陷鼠的組織切片問我說這隻小鼠肉眼病變盲腸腫大,半固體水樣大腸內容,但是組織病理又找不到明顯大腸病變。我就問他:您有沒有小腸的切片? 結果我拿小腸切片看了一眼就和他說是「SFB」。 SFB是一種片節狀纖維狀桿菌 (Segmented Filamentous Bacteria),完全無法由細菌培養方法確診,此菌的片節插入被感染小鼠的小腸絨毛而造成異常菌增生及腸功能異常,也有報告認為它是一種共生菌,正反意見皆有 (Ericcson AC et al., 2014)。大部份的實驗動物設施皆未將 SFB 列入 SPF 清單中 (圖二)。以上舉列說明的新興病原例子,告訴我們健康監測方式是動物照顧計劃中很重要的一部份,一不小心,不旦動物可能全數撲殺,損失慘重,甚至研究人員的數據可信度付之東流,無法重覆實驗結果。
實驗動物獸醫皆需要與時俱進,值此新冠病毒橫行全球時刻,我輩皆勿忘初心,增進及改善動物福祉是我們終身努力的目標。
參考文獻
- Buchheister S and Bleich A, Health monitoring of laboratory rodent colonies—talking about (r)evolution. https://doi.org/10.3390/ani11051410, 2021.
- Carriquiriborde M et al., Microbiological contaminations of laboratory mice and rats in conventional facilities in Argentina. https://doi.org/10.1016/j.ram.2019.05.003, 2019.
- Ericsson AC et al., Segmented filamentous bacteria: commensalmicrobes with potential effects on research, Comp Med 64(2): 90-98, 2014.
- Fahey JR and Olekszak H, An Overview of typical infections of research mice: health monitoring and prevention of infection, Curr Protoc Mouse Biol 5:235-245 doi: 10.1002/9780470942390.mo150023, 2015.
- Kim et al., Histopathology of Pneumocystis carinii pneumonia in immunocompetent laboratory rats. Exp Ther Med 8: 442-446, 2014.
- Liang CT et al., Microbial contaminations of laboratory mice and rats in Taiwan from 2004 to 2007. JAALAS 48(4): 381-386, 2009.
- Ma¨hler M et al., FELASA recommendations for the health monitoring of mouse, rat, hamster, guinea pig and rabbit colonies in breeding and experimental units. Lab Anim 48(3): 178–192, 2014.
- Pritchett-Corning KR et al., Contemporary prevalence of infectious agents in laboratory mice and rats, Lab Anim 43: 165–173. doi: 10.1258/la.2008.008009. 2009.
- Roediger B et al., An atypical parvovirus drives chronic tubulointerstitial nephropathy and kidney fibrosis. Cell 175: 530–543, e1–e15, 2018.
- Su CM et al., The origin and past demography of murine astrovirus 1 in laboratory mice. J Gen Virol 102: 001520 DOI 10.1099/jgv.0.001520,2021.
- Treuting PM et al., Of mice and microflora: considerations for genetically engineered mice. Vet Pathol 49(1): 44-63, 2012.
- Weisbroth SH, Pneumocystis: newer knowledge about the biology of this group of organisms in laboratory rats and mice. Lab Anim (NY) 35(9): 55-61, 2006.