大腸癌實驗動物模式
翁德志 助理教授
中國文化大學保健營養學系
臺北醫學大學保健營養學系博士
大腸癌為結腸癌與直腸癌之總稱,根據106年國人死因統計結果顯示 [1],結、直腸癌位居男、女十大癌症死因第三名,其每年發生與死亡人數呈快速增加的趨勢。在過去,大腸癌在亞洲國家以及台灣的發生率與盛行率相對少於西方國家;然而,隨著飲食西化,國人偏好紅肉與燒烤油炸食物,水果及蔬菜攝取嚴重不足之下,長期下來的營養攝取嚴重失衡,都會增加大腸癌罹患的風險。
為了能讓研究人員有效利用實驗動物模式探討人類大腸癌的致病機轉,進而尋找具開發潛能之大腸癌預防物質或抑制腫瘤生長之物質,本專欄將簡要概述大腸癌發生的分子機轉與大腸癌實驗動物模式。
大腸癌分子病理學
90年代初期,學者 Fearon 與 Vogelstein 提出大腸癌的致癌模式 [2]:正常的腸道黏膜與上皮細胞(epithelium)可能因飲食中致癌物質之影響而出現異常增生(hyperplasia)病灶,增生的細胞在不斷的累積下,逐漸形成腺瘤(adenomas)或是息肉(polyps),接著進一步癌化而發展成為惡性腫瘤;此時若癌化的細胞持續增生,最終將侵犯腸壁組織與穿透血管,沿著血流出現遠端轉移(metastasis)進而侵犯其他器官或組織。一般而言,腸道黏膜與上皮細胞的癌變過程是慢性且漸進的,其與一連串的致癌與/或抑癌基因突變息息相關,舉例來說:抑癌基因APC(adenomatous polyposis coli)突變導致腫瘤細胞無法凋亡而逐漸增生、KRAS 基因活化而促使腺瘤更加分化不良、抑癌基因 DCC(deleted in colorectal cancer)與 TP53 的功能喪失,導致細胞與細胞之間或細胞與基質之間的黏附作用異常,影響細胞週期與凋亡的進行,而最終造成腺瘤細胞惡化形成大腸癌細胞。若讀者想更進一步完整了解大腸癌相關之分子生物學及訊息傳遞路徑,可參閱學者 Fearon 相關發表著作 [3,4]。
大腸癌實驗動物模式
實驗動物的種類與疾病誘發模式,對於實驗結果有顯著性的影響性。因目前鮮少有自發性大腸癌腫瘤發生的囓齒類動物,一般建議,研究者透過實驗動物建立大腸癌模式時,應留意:(1)動物之腫瘤需僅限生長於大腸,避免誘發模式對於其他組織的影響而干擾研究者對於大腸癌研究結果之判讀;(2)結、直腸的組織病理切片特徵,應與人類大腸癌疾病表徵有一定的相似程度;(3)留意所使用的動物模式是否能夠真實模擬大腸癌致病相關的訊息傳遞路徑彼此間的交互作用。目前由文獻得知,有許多方式可誘發實驗動物大腸癌,如:(1)調整飼料配方組成、(2)化學致癌物誘發模式、(3)選用基因異常動物誘發大腸癌與(4)腫瘤細胞移植模式等方式。以下茲針對此四種方式進行介紹。
調整飼料配方組成
高脂、高糖、低纖維、維生素與礦物質不均衡的飲食型態為西式飲食(Western diet)的主要特徵。Newmark等(1990)模擬西式飲食型態調整 AIN-76A 飼料中脂肪、鈣與維生素D的含量(fat: 20% vs. 5%; Ca: 0.05% vs. 0.5%; vitamin D:100 IU/kg diet vs. 1000 IU/kg in the AIN76A diet),餵食 12 週發現此飼料配方可造成大鼠與小鼠大腸癌前期病變之異常腺窩病灶 (aberrant crypt foci, ACF)發生 [6];Risio等(1996)以相同飼料配方餵食 C57BL/6 小鼠 2 年後,其遠端大腸有異常腺窩與腺瘤之發生,並於大腸上皮細胞觀察到核異型 (nuclear atypia)與發育不良腺窩等大腸癌分化異常指標 [7];Newmark 等(2001)降低西式飲食型態飼料配方中纖維、葉酸、甲硫胺酸與的膽鹼含量,餵食 C57BL/6 小鼠 2 年,約有 25% 小鼠可明確觀察到腸道腫瘤的發生 [8]。
調整飼料配方而誘發大腸癌的實驗動物模式,雖然貼近模擬或複製人類飲食型態不均衡對於大腸癌進展相關指標的影響,然而此誘發模式仍存在一些事項需要注意:第一、目前仍缺乏西式飲食型態造成基因突變而導致癌症發生的直接證明,除了學者 Fearon 與 Vogelstein 提出大腸癌的致癌模式之外,飲食是否會影響其他大腸癌發生的相關分子機制,仍須有完善的實驗設計;第二、調整 AIN-76A 飼料中鈣與維生素D的含量對於實驗動物有極大的影響,鈣與維生素D含量不足不僅造成動物骨骼生長異常,鈣與磷的比例失衡可能會影響到其他礦物質的吸收與利用,進而無法真實反映人類飲食西化對於大腸癌發生的生理改變與影響。
化學致癌物誘發模式
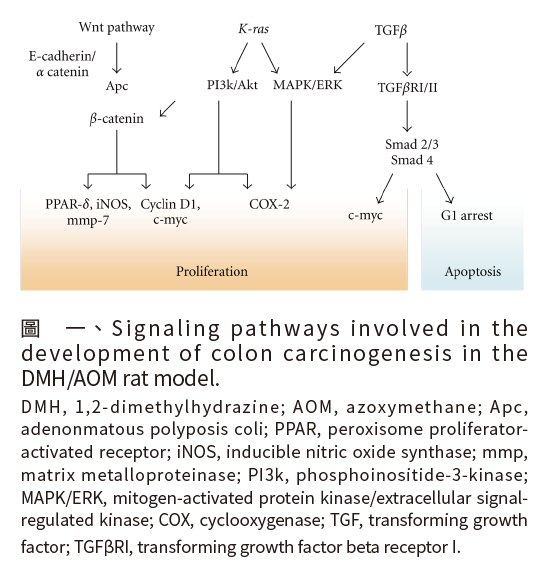
研究者可以透過皮下注射或腹腔注射 1,2-dimethylhydrazine(DMH)或其代謝物 azoxymethane(AOM)誘發實驗動物發生息肉型腸腫瘤 [9]。DMH 與 AOM 為目前廣泛使用於大腸癌實驗動物模式中的化學致癌物。DMH 對於大腸腫瘤誘發具有高度的特異性與劑量效應。當 DMH 進入體內後,經肝臟代謝產生中間產物AOM,AOM 會透過肝臟進一步的代謝而產生 methylazoxymethanol(MAM),MAM 可以隨著膽汁直接進入腸道,或是經由血液運送至大腸上皮細胞後,進一步造成腸道細胞 DNA 甲基化,進而引發大腸細胞異常生長。研究發現 [10,11],小鼠每週一次、連續4週腹腔注射每公斤體重 10 毫克 AOM,可成功於 10 週內以甲基藍染色觀察到大腸癌前期病變之 ACF,於 26 週內可於末端結腸與直腸發現大腸腫瘤。
學者 Perse and Cerar(2011)提出 [9],DMH/AOM 誘發大腸癌動物模式中,許多基因變異、組織或細胞異常的表現、癌症病變發生之訊息傳遞路徑,皆與人類大腸癌進展過程相似(圖一)。因此,DMH/AOM化學致癌物為良好模擬人類大腸癌進展之實驗動物模式。
選用基因異常動物誘發大腸癌
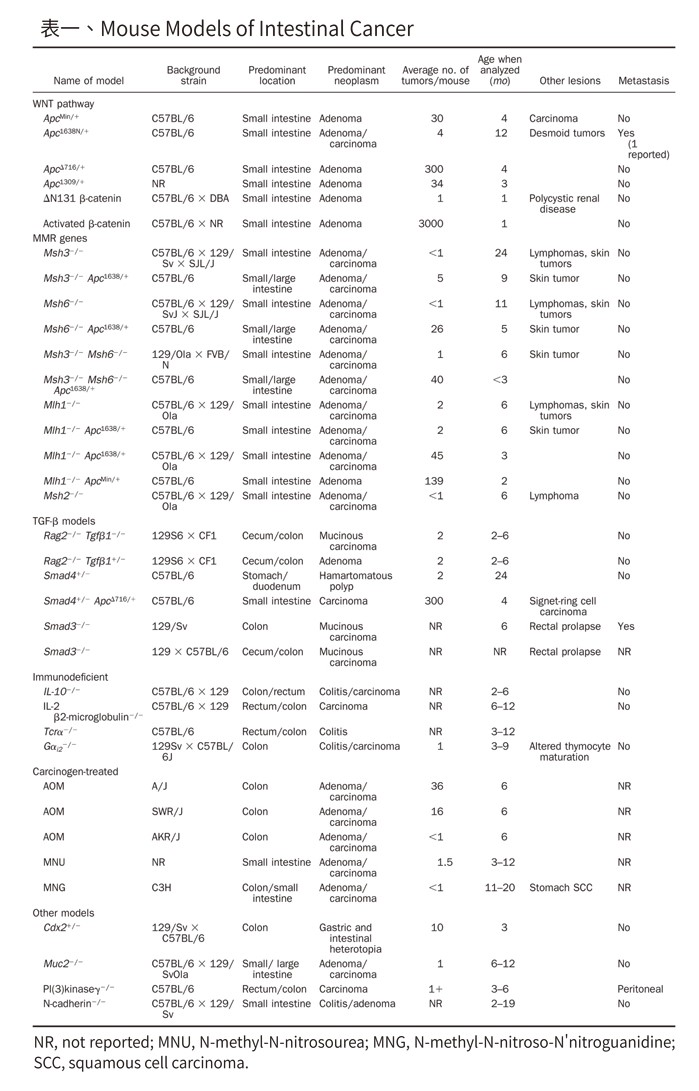
家族性腺瘤性息肉病 (familial adenomatous polyposis, FAP) 是一種遺傳性疾病,且為大腸癌高風險族群,其是由抑癌基因 APC 突變引起的 [12];患有 FAP 的患者在結腸和直腸中會表現出多發性息肉或腺瘤。1990 年,美國 Wisconsin-Madison 大學首次篩選出具有腸道多發性腺瘤(multiple intestinal neoplasia, Min)特徵的 APC 基因異常小鼠(ApcMin) [13],使得 FAP 的研究有了良好的實驗動物模式。當時,研究者將雄性 C57Bl/6J 小鼠暴露於致突變劑 ethylnitrosourea,並與雌性 AKR/J 小鼠雜交後觀察到,部份子代有較高的腸道腫瘤發生機率,並發現其 APC 基因之第 850 號編碼胺基酸發生無義突變 (nonsense mutation),即蛋白質合成進行到該點突變位置時就會提前終止,導致經轉錄及轉譯而成的APC蛋白產生結構缺陷,而無法有效的進行抑癌效果。一般來說,ApcMin 小鼠壽命約 120 天,往往伴隨慢性貧血與腸道阻塞的情形,為近 30 年來最常作為探討大腸癌發生機轉、治療與預防的實驗動物模式。
除了 ApcMin 小鼠之外,學者 Boivin 彙整了腸道腫瘤研究領域可以使用的實驗動物模式(表一),提供研究人員依據其實驗目的或需求的選擇參考 [14]。
腫瘤細胞移植模式
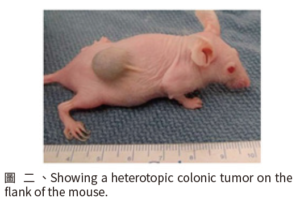
將腫瘤細胞移植到實驗動物身上為另一種大腸癌實驗動物模式的使用方式。依據移植的方式不同可分為:(1)同種移植 (allogeneic model),移植到動物體內的大腸癌細胞來自於同種動物所產生的,與(2)異種移植(xenograft model),移植到動物體內的大腸癌細胞不是同種動物所產生的。在此模式中又可因移植大腸癌細胞的位置不同而分成:(1)異位模式 (heterotopic model),使用皮下注射將大腸癌細胞移殖到實驗動物身上腸道以外的其他組織中使其生長(圖二) [15],(2)同位模式 (orthotopic model),將大腸癌細胞直接移植到實驗動物腸道中。一般來說,為了避免移植所導致的排斥作用,腫瘤細胞移植模式可選用免疫缺陷的裸鼠,或 SCID(severe combined immunodeficiency) 小鼠作為實驗動物模式,故可能較無法真實模擬免疫機能正常的情況。

參考文獻
- 統計處,2018。106年國人死因統計結果。
- Fearon and Vogelstein, 1990. A genetic model for colorectal tumorigenesis. Cell. 61: 759-67.
Fearon, 2011. Molecular genetics of colorectal cancer. Annu Rev Pathol. 6: 479-507. - Fearon and Carethers, 2015. Molecular subtyping of colorectal cancer – time to explore both intertumoral and intratumoral heterogeneity to evaluate patient outcome. Gastroenterology. 148: 10-13.
- Johnson and Fleet, 2013. Animal models of colorectal cancer. Cancer Metastasis Rev. 32: 39-61.
- Newmark et al., 1990. Colonic hyperplasia and hyperproliferation induced by a nutritional stress diet with four components of Western-style diet. J Natl Cancer Inst. 82: 491-6.
- Risio et al., 1996. Apoptosis, cell replication, and western-style diet-induced tumorigenesis in mouse colon. Cancer Research. 56: 4910-6.
- Newmark et al., 2001. A Western-style diet induces benign and malignant neoplasms in the colon of normal C57Bl/6 mice. Carcinogenesis. 22: 1871-5.
- Perše and Cerar, 2011. Morphological and molecular alterations in 1,2 dimethylhydrazine and azoxymethane induced colon carcinogenesis in rats. J Biomed Biotechnol. 2011: 473964.
- Papanikolaou et al., 2000. Sequential and morphological analyses of aberrant crypt foci formation in mice of differing susceptibility to azoxymethane-induced colon carcinogenesis. Carcinogenesis. 21: 1567-72.
- Bissahoyo et al., 2005. Azoxymethane is a genetic background-dependent colorectal tumor initiator and promoter in mice: effects of dose, route, and diet. Toxicol Sci. 88: 340-5
Wang et al., 2019 Targeted next‐generation sequencing approach for molecular genetic diagnosis of hereditary colorectal cancer: Identification of a novel single nucleotide germline insertion in adenomatous polyposis coli gene causes familial adenomatous polyposis. Mol Genet Genomic Med. 7: e00505. - Moser et al., 1990. A dominant mutation that predisposes to multiple intestinal neoplasia in the mouse. Science. 247: 322-4.
- Boivin et al., 2003. Pathology of mouse models of intestinal cancer: consensus report and recommendations. Gastroenterology. 124: 762-77.
- Mittal et al., 2015. Animal models of human colorectal cancer: Current status, uses and limitations. World J Gastroenterol. 21: 11854-61.
De-Souza and Costa-Casagrande, 2018. Animal models for colorectal cancer. Arq Bras Cir Dig. 31: e1369.
圖一、Signaling pathways involved in the development of colon carcinogenesis in the DMH/AOM rat model.
DMH, 1,2-dimethylhydrazine; AOM, azoxymethane; Apc, adenonmatous polyposis coli; PPAR, peroxisome proliferator-activated receptor; iNOS, inducible nitric oxide synthase; mmp, matrix metalloproteinase; PI3k, phosphoinositide-3-kinase; MAPK/ERK, mitogen-activated protein kinase/extracellular signal-regulated kinase; COX, cyclooxygenase; TGF, transforming growth factor; TGFβRI, transforming growth factor beta receptor I.
表一、Mouse Models of Intestinal Cancer
NR, not reported; MNU, N-methyl-N-nitrosourea; MNG, N-methyl-N-nitroso-N’nitroguanidine; SCC, squamous cell carcinoma.
圖二 、Showing a heterotopic colonic tumor on the flank of the mouse.
表二、Animal models used for research in colorectal cancer, and their main advantages and
disadvantages
DMH, 1,2-dimethylhydrazine; AOM, azoxymethane; APC, adenonmatous polyposis coli; MMR, mismatch repair gene; PAF, population attributable faction; HNPCC, hereditary nonpolyposis colorectal cancer; CRC, colorectal cancer.